根據GlobalData最新報告指出,全球再生醫療市場正以高速成長,預計自2023年至2030年間以超過43%的年均複合成長率(CAGR)擴張,市場規模於2030年將突破500億美元。臺灣擁有世界頂尖的臨床醫療體系,衛生福利部自2018年推動《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》(簡稱《特管辦法》)以來已累積豐富經驗,更於2024年6月正式通過《再生醫療法》與《再生醫療製劑條例》,確立了從研發、製造到臨床應用的完整法制框架。
面對全球人口高齡化與難治性疾病攀升的挑戰,以「細胞治療」為核心的再生醫療應運而生。政府積極將其列為國家重點產業之一,推動產業鏈的垂直整合與跨域協作,期望透過法規革新與技術升級,加速創新療法落地,建構一個具備國際競爭力的生醫產業生態系。
一、細胞治療產業發展現況
細胞治療產業主要聚焦於利用基因、細胞及其衍生物,用以治療、修復或替換人體細胞、組織及器官之製劑或技術。在產業發展趨勢上,基因治療漸漸成為再生醫療的核心驅動與主要發展主軸。隨著技術演進,生技醫藥產業與人工智慧(AI)、自動化製造技術的整合,正加速推動產業從傳統實驗室操作邁向智慧化生產,成為細胞治療產業發展的重要趨勢。
為滿足臨床上對於高品質、標準化細胞製劑的多元需求,透過醫療機構、學研單位與生技公司的合作,導入符合GTP及PIC/S GMP規範的製程環境,涵蓋細胞採集、基因修飾、擴增培養、品質檢測與冷鏈運輸等環節。其發展重點不僅在於個別產品的研發,更強調產業鏈上中下游的串聯與分工,從實驗室研發走向規模化生產,提升治療的可及性與安全性,實現從「症狀控制」邁向「治癒疾病」的醫療新典範。
隨著基因編輯、病毒載體工程等關鍵技術快速發展,以及法規環境的完備,臺灣細胞治療產業處於關鍵轉型期。為了解決產品商業化後的量產挑戰,產業正逐步從單純的醫療技術研發,轉向重視「製劑化」與生產效能,這使得具備規模化生產能力的 CDMO(委託開發暨製造)模式成為銜接研發與國際市場的關鍵橋樑,為生技產業創造更多可能與價值。
二、細胞治療次領域發展概述
臺灣細胞治療產業涵蓋細胞來源管理、製劑開發製造與臨床應用三大核心面向,依其技術特性與產業分工可概略分為八大次領域,分別為:細胞與組織保存庫、免疫細胞治療、幹細胞再生技術、基因治療製劑、組織工程技術、細胞衍生物(如外泌體)技術應用、CDMO製造服務及臨床試驗與應用。各領域正隨著雙法上路與國際技術引進而持續演進,未來發展方向包括製程自動化、異體細胞應用,以及更具成本效益的量產解決方案。
(一)細胞與組織保存庫
產業鏈上游主要從事幹細胞與組織的收集與保存,為整體產業生態的重要基礎。涵蓋新生兒臍帶血、臍帶、乳牙、脂肪及周邊血等來源。目前國內細胞儲存市場穩定成長,業者除提供儲存服務外,亦逐步跨足間質幹細胞、免疫細胞及個人化健康細胞儲存。
(二)免疫細胞治療
免疫細胞治療是目前臨床應用最成熟且占比最高的領域,特別聚焦於癌症治療,包括CAR-T(嵌合抗原受體T細胞)、NK(自然殺手細胞)等技術 。國內已有業者如沛爾、路迦等投入CAR-T與記憶型T細胞技術開發,針對血液腫瘤與實體腫瘤進行臨床試驗,標誌我國逐步與國際先進細胞療法接軌。
(三)幹細胞再生技術
幹細胞技術主要應用於退化性疾病與組織修復,目前發展重點包含間質幹細胞(MSC)、誘導性多功能幹細胞(iPSC)等,應用範圍涵蓋神經退化、關節炎、慢性傷口及心血管疾病。國內廠商如長聖、仲恩等已針對急性心肌梗塞、小腦萎縮症等適應症推進至臨床二期或三期階段。
(四)基因治療製劑
基因治療透過將治療性基因導入人體以治療疾病,雖然技術門檻高,但臺灣已有如「展世達輸注溶液(Upstaza)」這類自主研發並獲國際核准的指標性產品,該產品不僅是臺灣首個自主研發的基因治療藥物,更是全球首個可直接注射入腦部的基因治療藥物,並已成功獲得歐盟與美國上市核准,顯示我國在罕見疾病治療領域具備研發實力。
(五)組織工程技術
組織工程製劑係利用加工、改造之組織或細胞,修復或替代人體組織器官,國內代表性發展如博晟生醫,專注於生物性再生骨材與軟骨修復技術,其自體軟骨修復技術已應用於膝蓋等關節部位,並持續透過策略聯盟開發高附加價值的複合性藥物,展現再生醫療在外科重建領域的潛力。
(六)細胞衍生物(如外泌體)技術應用
依據《再生醫療法》定義,再生醫療範疇包含基因、細胞及其「衍生物」。外泌體因具備修復與傳遞訊號功能,且相較於活細胞更易於保存與運輸,成為新興發展熱點。目前產業最關注的「人源細胞外泌體(Human Cell-Derived Exosomes)」,衛福部食藥署已陸續制定《人源細胞外泌體之化學製造管制(CMC)及非臨床安全性試驗技術指引》草案,將其納入正規醫藥品管理。
(七)CDMO製造服務
委託開發暨製造服務(CDMO)是臺灣產業鏈中游最具國際競爭力的環節,為因應臨床試驗與商業化需求,部分業者致力於打造亞洲再生醫療製造樞紐,例如仲恩生醫不僅建立了符合 PIC/S GMP 規格的細胞製劑廠,更於2024年成為臺灣首家獲得日本厚生勞動省(MHLW)核發「再生醫療等製品外國製造業者認定證」的企業,顯示臺灣製造品質已獲國際認可。此外,臺寶生醫則專注於細胞醫療設計與製造服務,與同業攜手推動台灣產業邁向國際。
(八)臨床試驗與應用
下游環節直接面向病患,隨著法規開放,臨床試驗件數持續增加,截至2025年8月,我國細胞治療新藥臨床試驗已核准102件,基因治療核准58件。此外,透過「特管辦法」核准的細胞治療技術案件亦達444件,累積了大量臨床實證數據,形成轉譯研究的重要平臺。
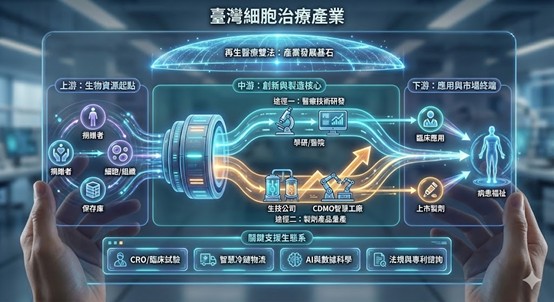 圖、臺灣細胞治療發展現況架構圖,呼應上述八大次領域與產業鏈結構
圖、臺灣細胞治療發展現況架構圖,呼應上述八大次領域與產業鏈結構
三、細胞治療未來發展趨勢
未來5至10年,臺灣細胞治療產業的發展將高度仰賴現成型(Off-the-shelf)異體細胞技術、自動化製造以及國際法規的協同推進,根據 GlobalData與再生醫療聯盟(Alliance for Regenerative Medicine, ARM)等國際權威機構的趨勢分析,全球產業正從高成本的「自體客製化」走向可大規模量產的「異體通用化」,這被視為產業邁向成熟的關鍵驅動力。
隨著《再生醫療法》正式實施,整體再生醫療生態系(涵蓋細胞治療、基因治療及其供應鏈)將呈現以下關鍵趨勢:
(一)治療模式的體內化與通用化
技術正由傳統的「體外細胞培養後回輸」,轉向直接在人體內作用的「體內(in vivo)模式」(如體內 CAR-T或基因治療),縮短製程時間並提升治療可及性。
(二)跨國藥廠與國內CDMO生態共榮
藉由「附款許可」機制吸引國際新藥來臺臨床試驗,並由國內CDMO廠商承接製造訂單,形成研發與製造的雙向合作模式。
(三)以數據為本的智慧製造系統
結合AI與數位孿生技術的自動化細胞工廠興起,不僅解決人力短缺問題,並提升產品良率與品質一致性,符合高規格監管要求。
(四)多元支付與風險分擔機制
針對高昂的治療費用,發展結合健保、商業保險與政府基金的混合型支付模式,提升病患對創新療法的可負擔性。
(五)治療領域快速商業化
從「癌症治療」延伸到「神經退化性疾病」、「代謝性疾病」及「眼科遺傳疾病」等,使再生醫療應用範圍大幅擴展。
四、總結
臺灣細胞治療產業的發展已跳脫過往僅聚焦於個案式臨床技術的範疇,逐步拓展至涵蓋研發、製程開發、量產製造及國際行銷等產業價值鏈全面需求,更強調建立標準、提升產能,並透過法規與制度創新解決商業化挑戰。
在建構臺灣成為亞洲再生醫療樞紐的目標下,產業發展將著重於技術與法規的國際接軌,同時透過強化 CDMO 製程優勢,提升國際競爭力及跨國臨床合作量能,推動科研成果轉化為具商業價值的產品,為全球醫療市場創造更多元且具影響力的解決方案。
資料來源:經濟部產業發展署